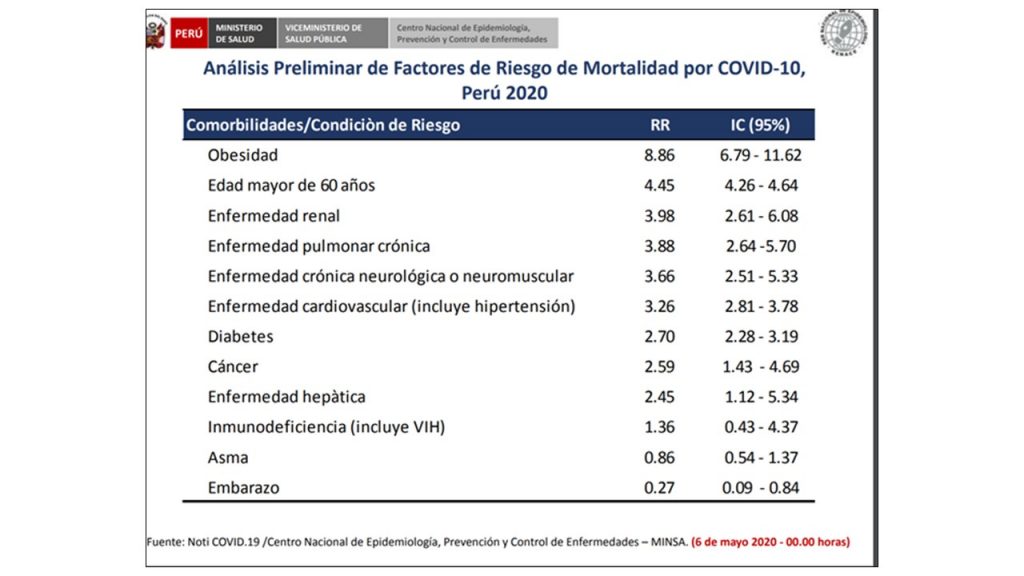
Obesidad y cáncer
La obesidad
Desde el punto de vista poblacional, la obesidad es la otra pandemia que golpea al mundo desde hace más de 4 décadas. En el año 2016, la Organización Mundial de la Salud (OMS) difundió un informe sobre la prevalencia mundial del sobrepeso/obesidad cuyos datos eran extremadamente alarmantes (1):
- La prevalencia mundial de obesidad se había triplicado entre 1975 y 2016.
- Más de 1250 millones de personas mayores de 18 años presentaban sobrepeso.
- Más de 650 millones de personas mayores de 18 años presentaban obesidad.
- Más de 340 millones de adolescentes entre 5 y 19 años presentaban sobrepeso u obesidad. En este grupo etario se había pasado de una prevalencia mundial de sobrepeso/obesidad de 4% en 1975 a una prevalencia mundial de 18% en 2016 y específicamente en el caso de la obesidad, se había pasado de una prevalencia mundial de 1% en 1975 a una prevalencia mundial de entre 6% (niñas) y 8% (niños) en 2016.
- Más 38 millones de niños menores de 5 años presentaban sobrepeso u obesidad.
- La mayor parte de la población mundial vivía en países donde la obesidad mataba más personas que la desnutrición.
- La obesidad ya no era un problema exclusivo de países de altos ingresos ahora, estaba presente en países de medianos y bajos ingresos (exceptuando algunos países asiáticos o de África subsahariana).
- En algunas partes de África, el sobrepeso había crecido aproximadamente 24% desde el año 2000.
El desarrollo de obesidad es un proceso crónico y degenerativo, en el cual, el individuo va rompiendo paulatinamente todos los controles orgánicos existentes y necesarios para evitar la ganancia de peso [Nota. Por ejemplo: falla el sistema hambre/saciedad que regula la ingesta y fallan las hormonas que regulan cuánta energía gastamos por cada una de nuestras actividades cotidianas]. El tejido adiposo se convierte, entonces, en el epicentro de decenas de cambios adaptativos y lesivos para el individuo. En principio, cada adipocito empieza a acumular grasa y a crecer desordenadamente (hipertrofia) alterando la estructura natural (desestructuración) del panículo adiposo que lo contiene. [Nota. El panículo adiposo es la forma en que se organiza el tejido adiposo y está conformado por dos columnas de adipocitos rodeados por tejido conectivo; alrededor de este panículo también encontramos macrófagos y células no diferenciadas]. La desestructuración del panículo genera, a su vez, un entorno hipóxico que promoverá rápidamente una respuesta pro-inflamatoria por parte de los adipocitos afectados. Estos empiezan a sintetizar gran cantidad de adipocinas (citoquinas producidas por el adipocito) entre las que podemos citar a la proteina quimioatrayente de monocitos-1 (MPC-1 por sus siglas en inglés para Monocytes Chemotactic Protein) (2). La MPC-1 promueve el cambio de los macrófagos M2 (con poco potencial inflamatorio y abundantes en el tejido adiposo de las personas delgadas) hacia macrófagos M1 (altamente inflamatorios y abundantes en el tejido adiposo de personas con sobrepeso/obesidad) (3). Los macrófagos M2 promueven, a continuación, la llegada de mayor número de macrófagos M2 procedentes de la médula ósea. La presencia de estos macrófagos no solo diversificará el número de adipocinas disponibles sino también su concentración. Conforme pasa el tiempo, la “enfermedad” del adipocito se va asentando y progresando: la mitocondria libera grandes concentraciones de radicales libres y el adipocito reduce drásticamente su síntesis de adiponectina [Nota. La adiponectina es clave en el desarrollo de la resistencia a la insulina: a menos adiponectina, mayor resistencia]. Consecuentemente, la alta disponibilidad de insulina y radicales libres motivará un proceso patológico de diferenciación adipocitaria que promoverá la aparición de nuevos adipocitos. En la tabla 1, se muestran algunos de los cambios metabólicos que están presentes en una persona con obesidad, lamentablemente, son los mismos factores que asocian este problema con el desarrollo del cáncer, pero eso lo describiremos más adelante en este documento.
Tabla 1. Algunos cambios metabólicos asociados con la obesidad
| Ø Resistencia a la insulina y las anormalidades en el sistema y la señalización del IGF-1. Ø Alteración en la síntesis y en las vías metabólicas de las hormonas sexuales. Ø Presencia de una inflamación crónica de bajo impacto y estrés oxidativo. Ø Alteraciones en el funcionamiento de las adipocinas. Ø Factores asociados con el depósito de grasa ectópica. Ø Alteraciones en el ritmo circadiano. Ø Alteraciones en la microbiota intestinal. |
El cáncer
El cáncer, por otro lado, crece continuamente a pesar de todos los esfuerzos llevados a cabo para reducir su incidencia y prevalencia. Según la Organización Mundial de la Salud (OMS) (4), los cánceres más comunes en el mundo para el 2020 fueron: el cáncer de mama (2.26 millones de casos), pulmón (2.21 millones de casos, colon y recto (1.93 millones de casos), próstata (1.41 millones de casos), piel (1.41 millones de caso, no melanoma) y estómago (1.09 millones de casos). De acuerdo con el Observatorio Global de la Agencia Internacional para la investigación sobre el cáncer de la OMS se proyecta que en el año 2040 habrán 27.5 millones de nuevos casos de cáncer en el mundo. Estos estarían relacionados con cambios demográficos como el crecimiento de la población, su envejecimiento y las mejoras en los ingresos económicos de los países. El cambio en el estilo de vida hacia la occidentalización, además, produciría en el tiempo una caída drástica en la prevalencia e incidencia de los cánceres asociados con infecciones hacia cánceres asociados con el estilo de vida (5).
El desarrollo del cáncer involucra decenas de procesos y cambios celulares y moleculares que transformarán una célula normal en una maligna. Estos cambios han sido agrupados en 03 etapas bien definidas: la iniciación, la promoción y la progresión. En la iniciación, una célula normal sufre una mutación en su ADN por exposición a agentes genotóxicos o de manera espontánea; esta célula pasa a ser llamada, célula iniciada [Nota. Se denomina genotóxico a un elemento físico o químico capaz de dañar directamente el ADN celular]. Los genotóxicos pueden incluir los rayos ultravioletas, tóxicos ambientales o sustancias presentes en los alimentos (ver artículo sobre Sustancias alimentarias promotoras de cáncer); mientras que las mutaciones espontáneas se producen por elementos endógenos como por ejemplo exceso de hormonas o radicales libres que acompañados de una falla en el proceso de reparación celular originan una célula mutante. En la promoción, se produce una proliferación selectiva de la célula iniciada que genera una lesión focal de células pre-neoplásicas. Estas células crecerán gracias a modificaciones en su expresión génica quen puede promover la división celular y/o disminuir su muerte programada (apoptosis). En la progresión, el crecimiento celular lleva a la formación de una neoplasia benigna o maligna (6).
Los factores de riesgo para desarrollar cáncer pueden ser agrupados en dos categorías: factores de riesgo no modificables y factores de riesgo modificables. Los factores no modificables incluyen a la edad (aparentemente vamos perdiendo la capacidad de reparar errores en las células conforme envejecemos), el sexo o la raza. Los factores de riesgo modificables incluyen: humo del cigarro, consumo de alcohol, sobrepeso/obesidad, actividad física insuficiente, exposición a rayos ultravioleta, factores dietarios (consumo de carne roja procesada, consumo excesivo de sal, consumo insuficiente de frutas y verduras, consumo insuficiente de fibra dietaria) (ver artículo sobre Factores protectores contra el cáncer) (7) e infecciones asociadas al cáncer (H. Pilori, virus de la hepatitis B, virus de la hepatitis C, virus del herpes humano tipo 8, virus de inmunodeficiencia humana y virus del papiloma). Justamente, los esfuerzos mundiales de prevención de cáncer giran en torno a estos factores.
¿Cuál es la relación entre cáncer y obesidad?
Según la Sociedad Americana del Cáncer 4 de cada 10 cánceres están asociados con los factores de riesgo modificables y el sobrepeso/obesidad aparece regularmente en cualquiera de las listas de factores asociados desarrolladas en el mundo. Whiteman et al (8) publicaron en 2015 un estudio llevado a cabo con información estadística de población australiana y concluyeron que fumar, exposición a rayos ultravioleta, sobrepeso/obesidad, dieta y consumo de alcohol explicaban más del 90% de los cánceres prevenibles en ese país.
El sobrepeso/obesidad está asociado con cáncer endometrial, esofágico, renal, pancreático, hepatocelular, gástrico (sobre todo a nivel de cardias), meningomas, mielomas múltiples, colon y recto, de mama en mujeres posmenopáusicas, ovario, vejiga y tiroides. La fracción atribuible poblacional (PAF, population attributable factor por sus siglas en inglés) es una medida estadística y epidemiológica que muestra cuál es la contribución que la exposición a un factor determinado puede tener sobre el desarrollo del cáncer. El estudio de whiteman et al (7) mostró que en el caso de cánceres asociados con el sobrepeso/obesidad, los PAF fluctuaron entre 10-40% dependiendo de si se trataba de hombres o mujeres o del tipo específico de cáncer; en concreto, la presencia de sobrepeso/obesidad incrementa 10-40% el riesgo de cáncer.
Como fue citado líneas arriba, la tabla 1 recoge algunos de los cambios metabólicos que se producen en una persona con obesidad. A continuación, describiremos cómo contribuyen con el desarrollo del cáncer.
Obesidad, resistencia a la insulina, anormalidades en el sistema y la señalización del IGF-1 y cáncer
El factor de crecimiento similar a la insulina 1 (IGF-1, por sus siglas en inglés para insulin-like growth factor I) es un polipéptido cuya estructura es un 50% semejante a aquella de la insulina. El 90% del IGF-1 se produce en el hígado por estímulo de la hormona de crecimiento y se piensa que está involucrado en la proliferación, migración, crecimiento y apoptosis celular. La insulina, por otro lado, se produce en el páncreas y es responsable de la regulación de la glucosa; sin embargo, también podría estar involucrada en la regulación de la diferenciación celular y el crecimiento tumoral. Diversos estudios han mostrado una sobre expresión de receptores de insulina en diversos tumores malignos (pecho, pulmón, colon y tiroides) (9). También se ha demostrado que niveles elevados de insulina, como aquellos que se producen en la resistencia a la insulina asociada a la obesidad, podrían estimular una mayor síntesis de receptores de insulina sobre todo los de tipo A que son mucho más sensibles a la presencia de IGF-1 (10). En este sentido, mientras más insulina circule en el torrente sanguíneo mayor será el estímulo para la síntesis de receptores de insulina en mayor cantidad de tejidos, lo cual, permitiría un mayor estimulo del IGF-1 (potente regulador de la diferenciación celular) y esto podría generar crecimientos celulares anormales generando las condiciones para el cáncer.
Obesidad, estrés oxidativo y cáncer
El estrés oxidativo es un estado celular en el cual los niveles de especies reactivas de oxígeno (ROS, por sus siglas en inglés para Reactive Oxygen Species) superan las barreras antioxidantes de la célula. Existe suficiente evidencia que liga la presencia de estrés oxidativo con la iniciación, promoción y progresión del cáncer. El exceso de ROS puede generar daños tanto en el ADN genómico como mitocondrial produciendo mutación de moléculas y alteración en las vías de señalización. Las bases purinas y pirimidinas son particularmente sensibles a la presencia de ROS generándose como consecuencia de esta interacción aductos (producto formado por la unión de dos moléculas) que alteran por completo la naturaleza de la molécula de ADN. En la tabla 2, se describen algunos de los efectos moleculares de las ROS ligados con el cáncer (6).
Tabla 2. Algunos efectos moleculares de las ROS ligados con el cáncer.
| Molécula afectada | Daño posible asociado con la exposición a las ROS |
| ADN genómico | Pueden producir mutaciones, deleciones, inserciones o traslocaciones cromosómicas en el ADN genómico las cuales, a su vez, serían capaces de activar oncogenes o inactivar genes supresores de tumores |
| ARN | Aunque es ARN es más resistente a la acción de las ROS, estás pueden dañarlo con lo cual se podría afectar negativamente la síntesis proteica y la expresión génica |
| Proteínas | Podrían afectar la actividad de enzimas involucradas con la reparación del ADN (las ADN polimerasas son particularmente susceptibles), transportadores de minerales al interior de la célula o cambios en los receptores celulares. |
| Lípidos | Provocan peroxidación lipídica. Esta puede generar cambios a nivel de membranas. El resultado de la peroxidación lipídica también puede producir sustancias genotóxicas. |
| ADN mitocondrial | El ADN mitocondrial es más susceptible al daño que el ADN genómico. Su alteración puede afectar los procesos de transferencia de electrones en la cadena respiratoria y generar una mayor liberación de radicales libres. |
Obesidad, inflamación crónica de bajo impacto y cáncer
La inflamación crónica de bajo impacto como aquella que se produce en la obesidad puede regular la carcinogénesis en sus tres etapas: iniciación, proliferación y progresión a través de diversos mecanismos entre los que se pueden citar: el estímulo a la proliferación acelerada, el aumento de la angiogénesis y la metástasis. La inflamación también puede activar factores de transcripción en las futuras células tumorales generando las condiciones para que puedan producir proteínas de fase aguda como la proteina C reactiva, citoquinas como las interleuquinas, adipocinas, interferones, familia del TNF entre otros [Nota. Los factores de transcripción son moléculas que activan la trascripción de genes, que continuará luego con la traducción y dará como resultado la formación de una proteína]. La confluencia de estas dos corrientes: la inflamación producida previamente en el individuo a consecuencia de la obesidad y la desestructuración del panículo adiposo más la inflamación que generan las nacientes células anormales dan como resultado un microambiente ideal que produce daño tisular, daño en el ADN y el desencadenamiento del cáncer.
Michels et al publicaron recientemente un metaanálisis de corte epidemiológico con el objetivo de identificar la relación entre parámetros inflamatorios rutinariamente informados y el riesgo de cáncer. Los parámetros más frecuentemente informados fueron proteina C reactiva (PCR), fibrinógeno, IL-6 y TNF; mientras que los menos informados incluían adiponectina o leptina. En general encontraron una alta correlación entre los valores plasmáticos elevados de estos compuestos, sobre todo PCR y el riesgo de cáncer de diversos tipos: colorectal, mama, pulmón, próstata, ovario, gástrico, endometrial entre otros (11).
Obesidad, adiponectina y cáncer
Una forma indirecta de medir el grado de afectación del adipocito es a través de la valoración de los niveles plasmáticos de adiponectina, una hormona con propiedades antiinflamatorias y directamente asociada con la sensibilidad del receptor de insulina: mientras más crónica y severa sea la desestructuración del panículo adiposo, menor será la síntesis adipocitaria de adiponectina. En este sentido, se han propuesto dos mecanismos que podrían explicar el efecto antineoplásico de la adiponectina. De manera directa, la adiponectina podría tener un efecto protector al activar la adenosina monofosfato kinasa (AMPK) una enzima crucial en la regulación del balance energético y responsable de la adaptación metabólica en la metainflamación y el estrés oxidativo asociado con la obesidad. En estas condiciones, la AMPK inactivaría las vías anabólicas y proliferativas, que promueven el cáncer, a favor de la producción de ATP que es una forma de almacenar la energía. La adiponectina jugaría un rol importante en la detección del crecimiento de células tumorales y su apoptosis. De modo indirecto, se ha propuesto que la adiponectina presenta propiedades antitumorales debido a sus efectos sobre los eventos que se llevan a cabo en el citoplasma celular después de que el receptor de insulina es activado; mientras la insulina estimula el crecimiento tumoral, la adiponectina lo inhibe. Por otro lado, también puede reducir la angiogénesis y la actividad de la aromatasa enzima responsable de la síntesis de estrógenos (12), hormonas cuyo exceso está asociado con el cáncer y pueden presentar una síntesis incrementada en mujeres con obesidad.
La obesidad es, de un modo u otro, un baúl profundo de sorpresas negativas para la salud de las personas. La acumulación de grasa y todos los desórdenes metabólicos asociados con ella, están fuertemente asociados con el desarrollo de cáncer y una larga lista de otras patologías.
Si quieres saber más sobre este tema y otros más, participa de los cursos taller gratuitos dirigidos a los miembros de la comunidad del Instituto IIDENUT. Haz click aquí para más información Afíliate a la comunidad del Instituto IIDENUT. Como miembro activo de nuestra comunidad, podrás participar GRATUITAMENTE del congreso iberoamericano del CIENUT que se llevará a cabo del 22-27 de noviembre. Inscríbete aquí.
Por Robinson Cruz
*Robinson Cruz es Director General del Instituto IIDENUT. Cuenta con 20 años de experiencia como nutricionista clínico y especialista en Bioquímica aplicada a la Nutrición. Es investigador y docente invitado en los programas de nutrición de pre y posgrado de decenas de universidades en 20 países de Iberoamérica. Más de medio millón de profesionales siguen sus publicaciones en diversos medios digitales. En este tiempo ha formado miles de profesionales de la nutrición, ha publicado casi una docena de libros y cientos de comunicaciones relacionadas, entre otras actividades. https://orcid.org/0000-0002-8056-1822
DECLARACIÓN DE PRINCIPIOS
En IIDENUT rechazamos rotundamente aquellas prácticas asociadas con el uso inapropiado de la información con fines comerciales. Nuestros estándares éticos nos impiden aceptar, difundir o parcializarnos subjetivamente con producto o práctica alguna que vaya en contra o distorsione la labor científica del nutricionista/nutriólogo/dietista-nutricionista (dependiendo de la denominación del país).
Referencias bibliográficas
- World Health Organization (2020). Obesity and Overweight. Available at: https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight (acceso 07 de mayo de 2021).
- Catalan V, Fruhbeck G, Gómez J. Inflammatory and Oxidative Stress Markers in Skeletal Muscle of Obese Subjects. ttps://doi.org/10.1016/B978-0-12-812504-5.00008-8
- Andrade FB, Gualberto A, Rezende C, Percegoni N, Gameiro J and Hottz ED (2021) The Weight of Obesity in Immunity from Influenza to COVID-19. Cell. Infect. Microbiol. 11:638852. doi: 10.3389/fcimb.2021.638852
- Organización Mundial de la Salud. Cancer. https://www.who.int/news-room/fact-sheets/detail/cancer
- Hulvat M. Cancer Incidence and TrendsSurg Clin N Am 100 (2020) 469–481 https://doi.org/10.1016/j.suc.2020.01.002
- Klaunig J. Oxidative Stress and Cancer. Current Pharmaceutical Design, 2018, Vol. 24, No. 40
- Whiteman D, Wilson L. The fractions of cancer attributable to modifiable factors: A global review Cancer Epidemiol 2016 Oct;44:203-221. Doi: 10.1016/j.canep.2016.06.013. Epub 2016 Jul 25.
- Whiteman D, Webb P, Green A, Neale R, Fritschi L Bain C, Parkin M et al. Cancers in Australia in 2010 attributable to modifiable factors: summary and conclusions. Aust NZ J Public Health. 2015; 39:477-84; doi: 10.1111/1753-6405.12471
- Argirion I, Weinstein S, Moannisto S, Albanes D, Mondul A. Serum Insulin, Glucose, Indices of Insulin Resistance, and Risk of Lung Cancer. Cancer Epidemiol Biomarkers Prev; 26(10) October 2017
- Belfiore A, Malaguarnera R, Vella V, Lawrence M, Sciacca L, Frasca F, Morrione A, Vigneri R. Insulin Receptor Isoforms in Physiology and Disease: An Updated View. Endocrine Reviews, October 2017, 38(5):379–431
- Michels N, Van Aart C, Morisse J, Mullee A, Huybrechts I, Chronic inflammation towards cancer incidence: A systematic review and meta-analysis of epidemiological studies Critical Reviews in Oncology / Hematology 157 (2021) 103177
- Tumminia A, Vinciguerra F, Parisi M, Graziano M, Sciacca L. Adipose Tissue, Obesity and Adiponectin: Role in Endocrine Cancer Risk. Int. J. Mol. Sci. 2019, 20, 2863; doi:10.3390/ijms20122863