Resistencia a la insulina
La resistencia a la insulina (RI), resistencia insulínica o insulino-resistencia es un evento metabólico en el cual los receptores celulares de la insulina, principalmente aquellos ubicados en hepatocitos, miocitos y adipocitos, presentan una respuesta anormalmente disminuida frente a la acción estimulante de la hormona (1).
La RI está asociada con alteraciones fisiopatológicas como aquellas que se desarrollan durante la obesidad o como parte de la respuesta orgánica a injurias graves como sucede en los pacientes críticos (2). No obstante, la RI no es un evento que se presente única y exclusivamente en medio de un cuadro patológico. De hecho, la RI se puede presentar de manera natural durante el tercer trimestre del embarazo (3) o durante la pubertad (4). En cualquiera de estas circunstancias, la RI es un evento potencialmente reversible que puede complicarse irremediablemente si existe de por medio un cuadro de obesidad.
Aunque la definición de resistencia a la insulina parece ser sencilla, involucra decenas de cambios orgánicos cuyas consecuencias paulatinamente van influenciando a todo el organismo. Sin premisas bioquímicas claras es difícil entender tanto el origen de esta condición como el impacto que tienen nuestras decisiones nutricionales sobre la respuesta clínica de los pacientes.
¿QUÉ ES EL RECEPTOR DE INSULINA?
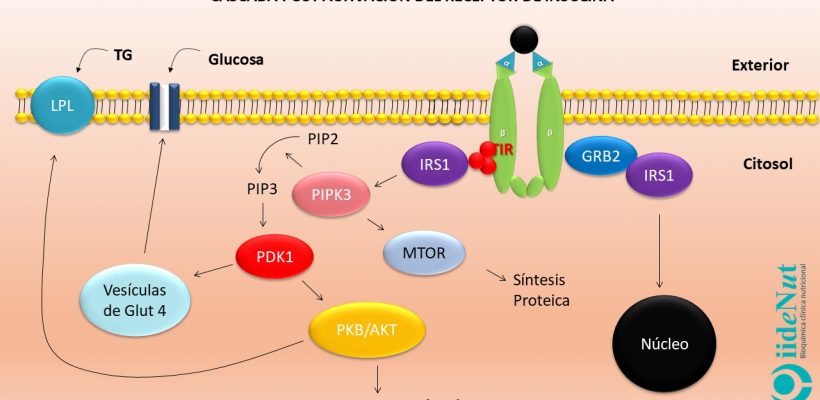
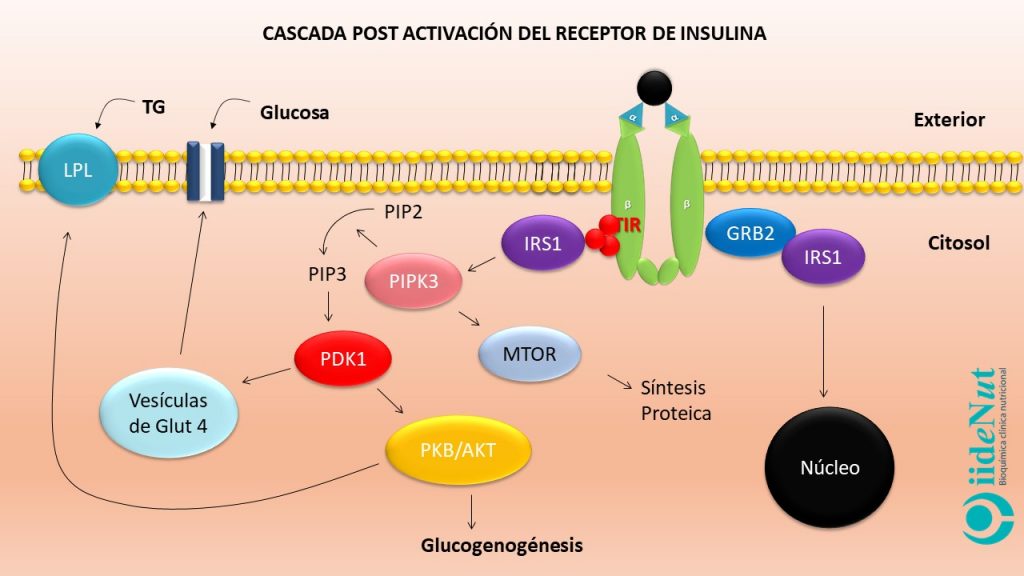
El receptor de insulina es una proteína que está conformada, a su vez, por 4 subunidades proteicas: dos subunidades alfa que sobresalen fuera de la célula y dos subunidades beta que atraviesan la membrana celular de lado a lado [Nota. El receptor de insulina es particularmente abundante en hígado, tejido adiposo y muscular].
¿CÓMO SE PRODUCE LA ACTIVACIÓN DEL RECEPTOR DE INSULINA?
Las subunidades alfa inhiben el funcionamiento de las subunidades beta. Cuando las subunidades alfa entran en contacto con la insulina se inactivan. La inactivación de las subunidades alfa anula su efecto inhibitorio sobre las subunidades beta permitiendo que estas últimas se activen. La activación de las subunidades beta hace que éstas empiezan a captar grupos fosfato a nivel de los residuos de tirosina (este proceso se llama autofosforilación del receptor) (5). Este evento es clave para entender la resistencia a la insulina, en términos moleculares, porque todos los eventos posteriores a la activación del receptor se llevarán a cabo, únicamente si la fosforilación se produce a nivel de los residuos de tirosina; si la fosforilación se presenta a nivel de los residuos de serina y treonina no habrá actividad fisiológica posterior.
¿QUÉ SUCEDE CUANDO EL RECEPTOR DE INSULINA ES ACTIVADO?
Si la activación del receptor de insulina se produce adecuadamente y a nivel del residuo de tirosina, éste empezará a captar unas proteínas citoplasmáticas que se denominan Sustrato del Receptor de Insulina 1 (IRS-1, por sus siglas en inglés para Insulin Receptor Sustrate) que a su vez pueden asociarse con diversos compuestos para desencadenar decenas de eventos metabólicos dentro de la célula, entre los que podemos citar:
- Liberación de receptores GLUT4 desde vacuolas que se encuentran en el plasma hacia la membrana celular. Los receptores GLUT4 permiten el ingreso de la glucosa en las células y, la reducción consecuente de la glicemia.
- Estímulo de la síntesis de glucógeno e inhibición de su degradación en hígado y músculo, con lo cual la glucosa es almacenada.
- Estímulo para la glucólisis e inhibición de la gluconeogénesis.
- Estímulo de la actividad de la Liproteina Lipasa (LPL) y triglicérido sintasa, con lo cual no solo se capta ácidos grasos hacia el interior de la célula, sino que además son almacenados como triglicéridos. Esto contribuye con su reducción en el torrente sanguíneo.
- Inhibición de la lipasa hormona sensible con lo cual se detiene la lipólisis.
*****************************************
Para más información, click sobre la foto
*****************************
¿CÓMO SE PRODUCE LA LIBERACIÓN DE INSULINA?
La glucosa es el principal estimulante y responsable de la secreción de insulina, aunque los ácidos grasos, los aminoácidos, las incretinas (péptidos producidos en el intestino por efecto de la presencia de alimento) y otros compuestos también pueden actuar como secretagogos (6). Cuando la glicemia sube, la glucosa ingresa libremente a las células pancreáticas a través de los receptores GLUT2 [Nota. Debe haber una alta concentración de glucosa en plasma para que se produzca este ingreso]. En el interior, la glucosa es metabolizada y el ATP producido inhibe los canales de potasio sensible a ATP, produciéndose, en consecuencia, el ingreso de calcio a la célula. Este calcio desencadena varias reacciones consecutivas que culminan en la ruptura de la unión péptido C – insulina y la posterior liberación de insulina [Nota. La proinsulina, una proteína de 101 aminoácidos formada por péptido c e insulina es la forma bajo la cual se almacena la insulina en el citoplasma de la célula beta. Cuando el calcio sube la proinsulina se rompe en sus componentes: péptido c (50 aminoácidos) e insulina (51 aminoácidos). Hasta un 10% de la proinsulina se libera intacta].
¿CÓMO SE DESARROLLA Y QUÉ SUCEDE EN LA RESISTENCIA A LA INSULINA?
Como ya se comentó líneas arriba, la resistencia a la insulina es un evento metabólico en el cual los receptores celulares de la insulina dejan de responder a la acción estimulante de la hormona. Pero ¿por qué los receptores dejan de responder? Se ha propuesto que, en personas con obesidad, el consumo excesivo de energía genera una acumulación anormalmente alta de ácidos grasos (AG) en el citoplasma de las células. En ese contexto, los AG interferirían con la fosforilación del receptor de insulina y, por ende, con todos los procesos de activación posteriores. Esta interferencia no permitiría la liberación de receptores GLUT4 por ende la glicemia se mantendría lo suficientemente alta como para estimular la liberación de mayor cantidad de insulina que forzará la “normalización” de la glicemia. Tampoco se producirá la activación de la lipoproteína lipasa con lo cual los ácidos grasos subirán en sangre o se afectará la síntesis de proteína muscular. Por otro lado, en los pacientes con inflamación la inactivación del receptor de insulina estaría mediada por la presencia de citoquinas pro-inflamatorias como el factor de necrosis tumoral (TNF).
Por Robinson Cruz
*Robinson Cruz es Director General del Instituto IIDENUT. Cuenta con 20 años de experiencia como nutricionista clínico y especialista en Bioquímica aplicada a la Nutrición. Es investigador y docente invitado en los programas de nutrición de pre y posgrado de decenas de universidades en 20 países de Iberoamérica. Más de medio millón de profesionales siguen sus publicaciones en diversos medios digitales. En este tiempo ha formado miles de profesionales de la nutrición, ha publicado casi una docena de libros y cientos de comunicaciones relacionadas, entre otras actividades. https://orcid.org/0000-0002-8056-1822
Referencias Bibliográficas
- Freeman AM, Pennings N. Insulin Resistance. 2021 Jul 10. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. PMID: 29939616
- Kampmann U, Knorr S, Fuglsang J, Ovesen P. Determinants of Maternal Insulin Resistance during Pregnancy: An Updated Overview. J Diabetes Res. 2019 Nov 19;2019:5320156. doi: 10.1155/2019/5320156. PMID: 31828161; PMCID: PMC6885766.
- Kelsey, M.M., Zeitler, P.S. Insulin Resistance of Puberty. Curr Diab Rep16, 64 (2016). https://doi.org/10.1007/s11892-016-0751-5
- Barazzoni R, Gortan Cappellari G, Ragni M, Nisoli E. Insulin resistance in obesity: an overview of fundamental alterations. Eat Weight Disord. 2018 Apr;23(2):149-157. doi: 10.1007/s40519-018-0481-6. Epub 2018 Feb 3. PMID: 29397563.
- Rivas AM, Nugent K. Hyperglycemia, Insulin, and Insulin Resistance in Sepsis. Am J Med Sci. 2021 Mar;361(3):297-302. doi: 10.1016/j.amjms.2020.11.007. Epub 2020 Nov 8. PMID: 33500122.
- Mendivil Anaya Carlos Olimpo, Sierra Ariza Iván Darío. ACCIÓN INSULÍNICA Y RESISTENCIA A LA INSULINA: ASPECTOS MOLECULARES. rev.fac.med. [serial on the Internet]. 2005 Oct [cited 2015 Dec 02] ; 53( 4 ): 235-243. Available from: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-00112005000400005&lng=en.
- Leyva M, Rodríguez Y, Rodríguez R, Niño S. Mecanismos moleculares de la secreción de insulina. Correo Científico Médico (CCM) 2020; 24(2)
DECLARACIÓN DE PRINCIPIOS
En IIDENUT rechazamos rotundamente aquellas prácticas asociadas con el uso inapropiado de la información con fines comerciales. Nuestros estándares éticos nos impiden aceptar, difundir o parcializarnos subjetivamente con producto o práctica alguna que vaya en contra o distorsione la labor científica del nutricionista