¿Cuál es el destino de la grasa que comemos?
Para empezar, es necesario hacer algunas precisiones:
i) La grasa es un tipo de lípido conformado por un glicerol y 3 ácidos grasos (a este compuesto le llamamos, triglicérido).
ii) Existen otros tipos de lípidos tales como: los fosfolípidos (además de ácidos grasos, contienen compuestos como grupos fosfatos o sacáridos), los isoprenoides (vitaminas), los esteroides (compuestos derivados del colesterol) y los eicosanoides (prostaglandinas, tromboxanos y leucotrienos).
iii) Los ácidos grasos que conforman un triglicérido serán mayoritariamente saturados o mayoritariamente insaturados en función de su origen animal o vegetal, respectivamente [Nota. De manera natural, los tres ácidos grasos que conforman un triglicérido (TG) son diferentes, solo en lípidos sintéticos como los triglicéridos de cadena media (TCM), los tres ácidos grasos son iguales y de cadena media].
iv) Las grasas, es decir los TG, representan el 95% de todos los lípidos disponibles en la naturaleza; los fosfolípidos el 4% y los demás solo 1%, lo cual no significa que sean menos importantes desde el punto de vista metabólico.
v) En el presente artículo tan solo nos referiremos a las grasas.
EL DESTINO DE LOS ÁCIDOS GRASOS
Como ya se precisó, las grasas o triglicéridos están conformadas por tres ácidos grasos y estos presentan destinos diferentes en función de sus características bioquímicas particulares. A continuación, detallaremos que sucede con cada uno de ellos.
Los ácidos grasos de cadena corta
Son saturados y como se forman en el rumen de la vaca, cabra y otros rumiantes, los lácteos son la principal fuente alimentaria. Bioquímicamente, no necesitan ser emulsionados, por lo tanto, no requieren de la presencia de sales biliares [Nota. La emulsión no es un proceso digestivo, la emulsión reduce el tamaño físico de los conglomerados de grasa para que, luego pueda ser digerida por la lipasa pancreática]. No son utilizados en la síntesis de quilomicrones (hablaremos de esta molécula más adelante) y su destino mayoritario es el colon, donde son empleados como alimento del colonocito.
Los ácidos grasos de cadena media.
Son saturados y los encontramos en diferentes alimentos, siendo el aceite de coco una de sus principales fuentes alimentarias [Nota. El aceite de coco tiene, además, otros tipos de ácidos grasos]. Bioquímicamente, no necesitan ser emulsionados, por lo tanto, tampoco requieren de la presencia de sales biliares. No son utilizados para la síntesis de quilomicrones y su destino inmediato es la circulación porta y el hígado.
Los ácidos grasos de cadena larga
Pueden ser saturados o insaturados dependiendo del origen de la grasa consumida. Son los más abundantes en la naturaleza. Bioquímicamente, primero deben ser emulsionados, para luego ser digeridos; por este motivo, necesitan de la presencia de sales biliares. Cuando por alguna razón, la liberación de bilis hacia la luz intestinal es deficiente, estos ácidos grasos no son emulsificados ni digeridos, se acumulan en el intestino, generan desequilibrios osmolares y desencadenan diarreas con características peculiares. Los ácidos grasos de cadena larga son la base para la formación de quilomicrones, por lo tanto y para continuar con el resto del camino, hablemos ahora de ellos.
EL PAPEL DEL QUILOMICRÓN
Los quilomicrones son un tipo de lipoproteína, la más grande de todas las existentes [Nota. Las lipoproteínas son complejos macromoleculares conformados por apoproteínas, triglicéridos y colesterol en diferentes proporciones]. Cuando las grasas son emulsionadas y posteriormente digeridas, liberan sus ácidos grasos (saturados e insaturados), los cuales ingresan al enterocito rodeados de ácidos biliares; esta estructura se denomina micela.
Dentro del enterocito, la micela se rompe, los ácidos grasos son liberados y se re-esterifican inmediatamente hasta triglicéridos (poseen ácidos grasos saturados e insaturados). Estos triglicéridos, más los fosfolípidos que también fueron ingeridos en la dieta, más el colesterol dietario y el sintetizado por el hígado que fue liberado a la luz del intestino en la bilis, más distintas apoproteinas (principalmente la ApoB48) generan un quilomicrón naciente. Este quilomicrón naciente pasa luego a la linfa y por ella alcanza el conducto torácico derecho para ser vertido al torrente sanguíneo.
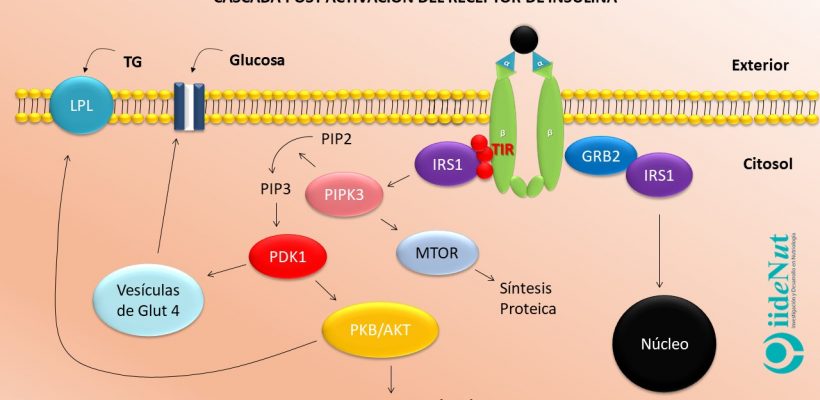
El 90% de estos quilomicrones se dirigirán al tejido adiposo y solo una décima parte alcanzará el tejido muscular. En ambos tejidos, la acción de la lipoproteína lipasa (LPL) le quita ácidos grasos que luego en el citoplasma de adipocitos y miocitos será re-esterificados hasta triglicéridos. Cabe precisar que los ácidos grasos saturados extraídos hacia el citoplasma son mayoritariamente saturados debido a que su estructura molecular los hace idóneos para el almacenamiento.
El quilomicrón mucho más pequeño que resulta del proceso anterior se denomina remanente de quilomicrón. En el hígado, el quilomicrón será degradado y todos sus componentes reutilizados. Los ácidos grasos saturados se almacenarán rápidamente y los ácidos grasos insaturados serán empleados para llevar a cabo procesos fisiológicos; sin embargo, si la cantidad de ácidos grasos insaturados que alcanza el hígado es constante e importante, éstos pueden ser utilizados para formar energía y debe notarse que si esa energía no es empleada termina siendo almacenada en el hígado como grasa, no obstante, eso es parte de otro tema [Nota. Desde que se consume el alimento hasta la llegada del remanente de quilomicrón al hígado transcurren entre 10 y 12 horas].
Por Robinson Cruz
*Robinson Cruz es Director General del Instituto IIDENUT. Cuenta con 20 años de experiencia como nutricionista clínico y especialista en Bioquímica aplicada a la Nutrición. Es investigador y docente invitado en los programas de nutrición de pre y posgrado de decenas de universidades en 20 países de Iberoamérica. Más de medio millón de profesionales siguen sus publicaciones en diversos medios digitales. En este tiempo ha formado miles de profesionales de la nutrición, ha publicado casi una docena de libros y cientos de comunicaciones relacionadas, entre otras actividades. https://orcid.org/0000-0002-8056-1822
DECLARACIÓN DE PRINCIPIOS
En IIDENUT rechazamos rotundamente aquellas prácticas asociadas con el uso inapropiado de la información con fines comerciales. Nuestros estándares éticos nos impiden aceptar, difundir o parcializarnos subjetivamente con producto o práctica alguna que vaya en contra o distorsione la labor científica del nutricionista